زرنيخ
الزرنيخ Arsines عنصر كيميائي لا فلزي ، رمزه الكيميائي As ، عدده الذري 33 ، كتلته الذرية 74،92 ، يقع في المجموعة الخامسة من الجدول الدوري الحديث.
| |||||||||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي
| |||||||||||||||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | زرنيخ, As, 33 | ||||||||||||||||||||||||||||||||||||
| النطق | /ˈɑrsənɪk/ ARS-ə-nik, also /ɑrˈsɛnɪk/ ar-SEN-ik when attributive | ||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | شبه فلز | ||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 15, 4, p | ||||||||||||||||||||||||||||||||||||
| الوزن الذري القياسي | 74.92160(2) | ||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | أرغون]; 4s2 3d10 4p3] 2, 8, 18, 5 | ||||||||||||||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 5.727 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 5.22 گ·سم−3 | ||||||||||||||||||||||||||||||||||||
| نقطة التسامي | 887 ك, 615 °س, 1137 °ف | ||||||||||||||||||||||||||||||||||||
| النقطة الثلاثية | 1090 ك (817°س)، 3628 [2] كپا | ||||||||||||||||||||||||||||||||||||
| النقطة الحرجة | 1673 ك، مپا | ||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | (grey) 24.44 كج·مول−1 | ||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 34.76 كج·مول−1 | ||||||||||||||||||||||||||||||||||||
| السعة الحرارية المولية | 24.64 ج·مول−1·ك−1 | ||||||||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||||||||||||||
| حالات الأكسدة | 5, 3, 2, 1,[3] -3 (أكاسيده حمضية ضعيفة) | ||||||||||||||||||||||||||||||||||||
| سالبية كهربية | 2.18 (مقياس پولنگ) | ||||||||||||||||||||||||||||||||||||
| طاقات التأين (المزيد) |
الأولى: 947.0 كج·مول−1 | ||||||||||||||||||||||||||||||||||||
| الثانية: 1798 كج·مول−1 | |||||||||||||||||||||||||||||||||||||
| الثالثة: 2735 كج·مول−1 | |||||||||||||||||||||||||||||||||||||
| نصف القطر الذري | 119 پم | ||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±119 pm | ||||||||||||||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 185 pm | ||||||||||||||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري ثلاثي[1] | ||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | مغناطيسية معاكسة[4] | ||||||||||||||||||||||||||||||||||||
| المقاومية الكهربائية | (20 °C) 333 نانوΩ·m | ||||||||||||||||||||||||||||||||||||
| ناقلية حرارية | 50.2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| معامل ينگ | 8 گپا | ||||||||||||||||||||||||||||||||||||
| معامل الحجم | 22 گپا | ||||||||||||||||||||||||||||||||||||
| صلادة موس | 3.5 | ||||||||||||||||||||||||||||||||||||
| صلادة برينل | 1440 مپا | ||||||||||||||||||||||||||||||||||||
| رقم تسجيل كاس | 7440-38-2 | ||||||||||||||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر زرنيخ | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
يعتبر الزرنيخ من أشد المواد سمية, وكثيرآ ما استخدمته النساء بالتخلص من أعدائهن وذلك لسهولة الحصول عليه بحجة القضاء على الفئران, ويتم كشف أمرهم بسهولة مهما حاولن تنظيف الأدوات التي استعملت في عملية تناول الزرنيخ ومناقلته. اكتشفه الكيميائي ألبرتوس ماگنوس (1191ـ1280) Albertus Magnus، وكان أبقراط Hippocrates في القرن الرابع قبل الميلاد (460ـ377ق.م). يستخدم كبريت الزرنيخ realgar As4S4 لمداواة الالتهابات. وقد اكتشف بطرس أوپونوس Petrus Opunus سُمية الزرنيخ. وكاد ملك فرنسا شارل الرابع أن يقتل عام 1384 بثلاثي أكسيد الزرنيخ As2O3. ولا تزال تتردد شائعة الموت البطيء لناپليون بوناپرت بالزرنيخ عام 1821.
ويمكن الحصول على الزرنيخ من As2O3 ومن As2S3 ومن عمليات استحصال الرصاص والنحاس من الخامات. ويعطي تسخين FeAsS مع الأكسجين As2O3 تبعاً للتفاعل الآتي:
ويرجع As2O3 بالكربون المنشَّط activated carbon في المجال 700ـ800 ْس تبعاً للتفاعل الآتي:
يحصل على زرنيخ نقاوته عالية جداً لاستخدامه في تكنولوجيا أنصاف النواقل من هدريد الزرنيخ تبعاً للتفاعل الآتي في الدرجة 600 ْس حيث يتفكك إلى هدروجين وزرنيخ نقي:
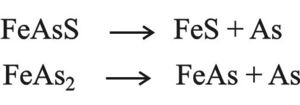
وتبلغ نسبة الزرنيح نحو 6×10-4% في الطبيعة وهي غير اقتصادية لأنها متبعثرة في كل مكان. من خامات الزرنيخ المهمة: بيريت الزرنيخ FeAsS، بيريت زرنيخي FeAs2، كبريت الزرنيخ As2S3، رباعي كبريت الزرنيخ AsS، زرنيخ صاف.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التعريف
الزرنيخ عنصر كيميائي لافلزي، رمزه الكيميائي As. وهو سم قاتل، ويسبب التعرض الطويل لجرعات صغيرة منه السرطان للإنسان. وتحتوي الكثير من سموم الفئران ومبيدات الحشرات والنباتات الطفيلية على الزرنيخ. كما يستعمل في تصنيع طلقات البنادق الرصاصية، وبعض أنواع المعدات الكهربائية، ولزيادة قوة بعض السبائك، أي خلطات الفلزات بالفلزات واللافلزات الأخرى.
أشكاله
هناك ثلاثة أشكال صلبة للزرنيخ:
1- الزرنيخ الرمادي،
2- الزرنيخ الأصفر،
3- الزرنيخ الأسود.
والزرنيخ الرمادي هو الشكل المعتاد للعنصر. له مظهر براق وهو موصل جيد معتدل للحرارة والكهرباء. لكن الزرنيخ الرمادي متقصف ويتكسر بسهولة. وعندما يسخن الى 613°م، فإن الزرنيخ الرمادي يتسامى أي يتحول مباشرة الى بخار دون أن ينصهر.
خواص الزرنيخ الفيزيائية
رمزه As والعدد الذري (رقم العنصر): 33 والكتلة الذرية: 74.9216 والترتيب الالكتروني للذرة: [Ar]3d10 4s24p3.
أنصاف أقطار: الذرة 1.2أنغستروم والشاردة 2.22(AS3-) أ والشاردة 0.69(AS3+)أ .
الكتلة الحجمية: 5.780غ/سم3، درجة الانصهار (الزرنيخ الرمادي): 718 ْ س (والضغط 27.5 بار)، درجة الغليان (تصعيد الزرنيخ الرمادي): 616 ْس، الكهرسلبية: 2.2 وفقاً لـ A.L.Allred وE.G.Rochow،
- كمون التشرد الأول
- الإلفة الالكترونية
- الناقلية الكهربائية
حيث: Ω-1==S. يرمز S إلى Siemens و Ω إلى Ohm.
للزرنيخ الأشكال المختلفة (modifications) الآتية:
الزرنيخ الرمادي أكثر أنواع الزرنيخ استقراراً و بلوراته رمادية فولاذية اللون لماعة، وناقليته للتيار الكهربائي أقل بنحو عشرين مرة من ناقلية النحاس، بلوراته هشة تسحق بسهولة.
ويعطي الشكل (2) بنية الزرنيخ الرمادي Asn.
خواص الزرنيخ الكيمياوية، أهم مركباته واستعمالاتها
يحترق الزرنيخ في الهواء برائحة الثوم مشكلاً الأكسيد As2O3، وبشكل مماثل يتفاعل مع العناصر الأخرى. يتفاعل مع الفلور والكلور من دون تسخين معطياً AsCl3 و AsF3 مع ظهور شرارة نار. ويعطي Asمع الأحماض المؤكسدة (حمض الآزوت المركز HNO3 والماء الملكي HNO3+3HCl) حمض الزرنيخ H3AsO4، ومع الأحماض الأقل أكسدة (حمض آزوت ممدد وحمض كبريت مركز) يعطي حمض الزرنيخي H3AsO3.
ويعطي As مع مصهور هيدروكسيدات المعادن القلوية Me (عناصر الفصيلة الرئيسة الأولى) أملاح الزرنيخيت (arsenite) تبعاً للتفاعل:
إن حمض الزرنيخي غير معروف بمعزل عن الماء. وبتبخير المحلول المائي للأكسيد As2O3 لا ينفصل الأكسيد As2O3 بل يتبلور على شكل مكعب صيغته As4O6. لكن حمض الزرنيخ معروف بمعزل عن الماء وصيغته هي H3AsO4. 0.5H2O (درجة الانصهار: 36.14ْس). ويُحضَّر من تفاعل As2O3 وحمض الآزوت المركز:
ويحضر الأكسيد As2O5 من H3AsO4 بتسخينه لدرجة 300 ْس تبعاً للتفاعل
من مركبات الزرنيخ المهمة
2ـ(chlorovinyldichloroarsine) ClCH=CHAsCl2 :lewisit مادة قتالية سائلة سامة ومهيجة.
(arsphenamine hydrochloride) salvarsan مادة اكتشفهـا (1908 ) Ehrlich ، اسـتخدمت فـي علاج مرض الزهـري (داء الأفـرنجي) syphillis، صيغتها As2(C6H3OHNH2)2.2HCl واسمها العلمي هو: 3 diamino-4-dihydroxylarsenobenzene.ـ وقد تراجع استخدام هذه المادة أمام المضادات الحيوية antibiotics من مجموعة البينيسيلات penicillins.
- ثلاثي كلوريد الزرنيخ AsCl3: سائل زيتي يستخدم في الصناعات الدوائية، وصناعة المواد القتالية وفي السيراميك.
- هدريد الزرنيخ arsine AsH3 : غاز له رائحة الثوم ويستخدم مادة قتالية.
وتستخدم أملاح حمض الزرنيخيت H3AsO3 في المجالات الآتية: مكافحة الحشرات والأعشاب الضارة ومواد حافظة للفرو والجلد وجميع هذه الأملاح أشد سمية من الزرنيخات.
الزرنيخات أي أملاح حمض الزرنيخ H3AsO4 مواد تستخدم في الصناعات الدوائية وفي صناعة مواد مكافحة الحشرات وفي صناعة الجلود وألوان الطباعة.
ويضاف أكسيد الزرنيخ As2O3 إلى مصهور الزجاج لطرد فقاعات الأكسجين الناتجة من تفكك النترات، فهو يربط O2 في المجال 1025ـ1230 ْس ويفقده بالتسخين في تفاعل عكوس عند الدرجة 1230 ْس.
ويستخدم As2O3 أيضاً في مكافحة الحشرات، وتضاءل استخدامه بوصفه مادة تلوين كما هي الحال في أخضر شفاينفورت [Cu (CH3COO)2.3Cu (AsO2)2] Schweinfurt.
تواجده
أحيانا يوجد الزرنيخ على صورته النقية في الطبيعة. ولكنه في الغالب يوجد في مزيج كيميائي مع الكبريت أو الأكسجين، أو مع فلزات مثل الكوبالت والنحاس والحديد والنيكل والفضة والقصدير. والمعدن الرئيسي الذي يحتوي على الزرنيخ هو الأرسينوبيريت، الذي يتكون من كبريتيد الحديد والزرنيخ. وأكثر مركبات الزرنيخ شيوعاً في الاستعمال هو الزرنيخ الأبيض، الذي يسمى أيضاً ثالث أكسيد الزرنيخ As2O3. ويتحصل عليه منتجًا جانبيًا في العادة عند صهر النحاس أو الرصاص. [5]
استخداماته
يستخدم عنصر الزرنيخ بشكل رئيسي في أنصاف النواقل. فإذا طعّمت به شبكة الجرمانيوم يتكوّن نصف ناقل من نوع السالب (negative) n لأن الزرنيخ يقدم إلكترونات متحركة في شبكة الجرمانيوم كما في الشكل (2). فالجرمانيوم رباعي التكافؤ والزرنيخ خماسي التكافؤ لهذا يتحرر الإلكترون من الزرنيخ
استعملت مركبات الزرنيخ منذ القدم لأغراض عديدة، بما فيها الأدوية والسموم. وكثيراً ما يُعزى الفضل للعالم الألماني ألبرتوس ماگنوس المعروف باسم القديس ألبرت الكبير، في عزل العنصر لأول مرة في حوالي 1250م. والعدد الذري للزرنيخ 33، ووزنه الذري 74,9216.
عملية تمثله لأن الكبد لم يعد قادراً على طرحه فيؤدي ذلك إلى الموت بعد نحو 36ـ96 ساعة. ويوجد في جسم إنسان وزنه 70كغ نحو 10مغ زرنيخ. و يطرح الكبد فائض الزرنيخ من المواد الغذائية (من الحيوانات المائية) على نحو مركب ثاني المثيل (CH3)2AsO2H مع البول. إن الغذاء الخالي من الزرنيخ يوقف نمو الجرابيع والدجاج.
Like phosphorus, arsenic is an excellent example of an element that exhibits allotropy, as its various allotropes have strikingly different properties. The three most common allotropes are metallic grey, yellow and black arsenic.[7]
تحيط الكواشف المخلبية بالشوارد المعدنية وتثبتها، وبالتالي تصبح الشوارد المعدنية غير قادرة على مهاجمة الجزيئات الحيوية في الجسم الحي، وإذا حدث ارتباط بين الشوارد المعدنية والجزيئات الحيوية تحرر الكواشفُ المخلبيةُ بعد إضافتها الجزيئات الحيوية لأن ارتباطها بالشوارد المعدنية هو الأقوى. ويلي ذلك طرح المعقدات المخلبية المتشكلـة بين الكواشف المخلبيـة والشوارد المعدنيـة السامة. وفي هذا المجال من المعالجات على أساس المعقدات المخلبية يُعرف المركب 2,3-dimercaptopropanol المعروف بـ British Anti Lewisit (BAL) والذي يستخدم ضد المادة القتالية المعروفة باسم (ClCH=CHAsCl2) Lewisit و يفضل اليوم استخدام (DMPS) 2,3-dimercaptopropanalsulfonic acid وهو ملح الصوديوم، الذي ينحل في الماء بصورة أفضل مما يسهل العمل الإنزيمي للحويصلة الصفراوية. ومن المواد (الأدوية) المستخدمة في المعالجة بالمعقدات المخلبية، يُذكر على سبيل المثال لا الحصر، (EDTA) ethylenediaminetertaacetic acid وpenicillamine .[8]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
السمية
- مقالة مفصلة: تسمم الزرنيخ
أشتهر الزرنيخ علي مدي قرون طويلة بأنه أوسع السموم استخداماً في قتل الآخرين وقد نشأت هذه السمعة من كونه يتمتع بصفات ثلاث وهي:
أولاً: أن مركباته تكاد تكون بلا طعم ولا رائحة أولون مميز حيث يسهل تقديمها في مختلف الأطعمة والمشروبات دون أن تثير الريبة. [9]:
ثانيا: ظهور أعراض التسمم بالزرنيخ يبدأ بعد فترة قد تطول إلي حد يبتعد فيه الجاني عن المجني عليه.
ثالثاً: أن الأعراض التسممية الناشئة عنه تختلط مع كثير من الأمراض المعوية السارية بحيث لا تثير شكاً لدي الطبيب المعالج .
وقد فقد الزرنيخ هذه السمعة بسبب سهولة الكشف عن وجوده حتى بعد تحلل جثة المتسمم تحللاً كاملاً إذ يمكن الكشف عنه في عظامه أوقي التربة أسفل الجثة.
ويستخدم الزرنيخ في مبيدات الطحالب والقوارض والدهانات وورق الحائط وفي صناعة السيراميك والزجاج ومن أخطر مركبات الزرنيخ سمية (ثالث أكسيد الزرنيخ) وهو مسحوق قابل للذوبان في الماء والجرعة القاتلة منه تتراوح بين 60إلي 20 ملليجرام ويتم امتصاصه عن طريق الأمعاء ببطء حيث تظهر الأعراض بعد فترة زمنية تتراوح من ربع ساعة إلي عدة ساعات . وهناك صورة أخرى وهي غاز الزرنيخ ويتم امتصاصه عن طريق الاستنشاق إلي الدم مباشرة وتشكل كميات ضئيلة منه في الهواء المحيط خطراً شديداً إذ تؤدي إلي التسمم الحاد في صورة تحلل كريات الدم ويتولد الغاز من معالجة المعادن المحتوية علي شوائب الزرنيخ بالأحماض أثناء تنظيفها.
أعراض التسمم بالزرنيخ:عند التسمم بالزرنيخ بالفم يكون هناك إحساس بطعم قابض يعقبه بعد ابتلاعه فترة كمون لا يظهر بها أعراض تتراوح ما بين 15 دقيقة إلي بضع ساعات حسب محتوي المعدة من الطعام ونوعه ، إذ يؤخر وجود طعام دهني امتصاص الزرنيخ لفترات طويلة بينما يعجل الامتصاص تعاطي الزرنيخ علي صورة محلول في مشروب ساخن . وتبدأ أعراض التسمم علي شكل قيء شديد وإسهال شديد (يشبه الكوليرا) ينشأ عنه جفاف سريع وانهيار. ويصل أيون الزرنيخ الممتص إلي الأعضاء والأنسجة الداخلية للجسم ليفسد عمل النظم الإنزيمية المعتمدة في عملها علي مجموعات السلفهيدريل (sulphhydryl groups).
أما في حالات التسمم المزمن بالزرنيخ فإن الأعراض التي تظهر علي المتسمم تشمل بالإضافة إلي القيء والإسهال المذكورين في الحالات الحادة، وجود هزال شديد وطفح جلدي نزفي مع زيادة في سمك الجلد ولا سيما في راحة اليدين وباطن القدمين (hyperkeratosis) واعتلال عصبي متعدد (polyneuropathy)، ويتم التأكد من الإصابة بقياس مستوى الزرنيخ بالبول حيث يندر أن يتعدى مقداره 0,3 ملليجرام باللتر. ويتم التشخيص بدقة أكثر بقياس محتوى الشعر والأظافر من الزرنيخ.
أما في حالات التسمم بغاز الأرسين فإن الأعراض تظهر على شكل انحلال كريات الدم الحمراء، فيشعر المريض برعشة وبآلام خاصة في موضع الكليتين ويتلون البول بلون قاتم وينشأ عن انحلال الكريات فشل بالكليتين وقد يتضخم الكبد والطحال بحيث يمكن تحسسهما. هذا وقد يتسبب التعرض المزمن للزرنيخ على مدى سنوات طويلة في زيادة الاستعداد لحدوث السرطان وخاصة الجلد ولكن قد ينشأ في أعضاء أخرى.
معالجة التسمم بالزرنيخ: يعتمد العلاج بالإضافة إلى وقف زيادة التعرض للزرنيخ إلى تخليص الجسم من الزرنيخ عن طريق الاستحلاب (chelation) بمادة البال (BAL) أما في حالات التسمم بغاز الأرسين فالمواجهه منع حدوث مزيد من التلف بالكلية حيث يجب عمل غسيل دموي (hemodialysis) وقد يلجأ إلى تبديل الدم (exchange transfusion) بسحب وتعويض المريض بدم حديث.
انظر أيضاً
المصادر
منير البيطار. "الزرنيخ".
- ^ Arsenic, mindat.org
- ^ Gokcen, N. A (1989). "The As (arsenic) system". Bull. Alloy Phase Diagrams. 10: 11–22. doi:10.1007/BF02882166.
- ^ Ellis, Bobby D. (2004). "Stabilized Arsenic(I) Iodide: A Ready Source of Arsenic Iodide Fragments and a Useful Reagent for the Generation of Clusters". Inorganic Chemistry. 43: 5981. doi:10.1021/ic049281s.
{{cite journal}}:|first2=missing|last2=(help) - ^ editor-in-chief, David R. Lide. (2000). "Magnetic susceptibility of the elements and inorganic compounds". Handbook of Chemistry and Physics (PDF) (81 ed.). CRC press. ISBN 0849304814.
{{cite book}}:|author=has generic name (help) - ^ الموسوعة المعرفية الشاملة
- ^ Brooks, William E. "Mineral Commodity Summaries 2007: Arsenic" (PDF). United States Geological Survey. Retrieved 2008-11-25.
- ^ Norman, Nicholas C. (1998). Chemistry of Arsenic, Antimony and Bismuth. Springer. p. 50. ISBN 9780751403893.
- ^ منير البيطار. "الزرنيخ". الموسوعة العربية.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
وصلات خارجية
- Los Alamos National Laboratory - Arsenic
- CTD's Arsenic page and CTD's Arsenicals page from the Comparative Toxicogenomics Database
- A Small Dose of Toxicology
- ATSDR - Case Studies in Environmental Medicine: Arsenic Toxicity
- Contaminant Focus: Arsenic by the EPA.
- Environmental Health Criteria for Arsenic and Arsenic Compounds, 2001 by the WHO.
- Evaluation of the carcinogenicity of arsenic and arsenic compounds by the IARC.
- National Institute for Occupational Safety and Health - Arsenic Page
- National Pollutant Inventory - Arsenic
- origen.net - CCA wood and arsenic: toxicological effects of arsenic
- WebElements.com - Arsenic