أكسيد الليثيوم
أكسيد الليثيوم مركب كيميائي غير عضوي له الصيغة Li2O ، ويكون على شكل مسحوق بلوري أبيض. على الرغم من عدم أهمية المواد على وجه التحديد ، يتم تقييم العديد من المواد على أساس محتواهم من Li2O. فعلى سبيل المثال، محتوى Li2O في معدن الليثيوم الرئيسي سپوديومين (LiAlSi2O6) هو 8.03%.[2]
| |
| |
 | |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Lithium oxide
| |
| أسماء أخرى
Lithia, Kickerite
| |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.031.823 |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | Li 2O |
| كتلة مولية | 29.88 g/mol |
| المظهر | white solid |
| الكثافة | 2.013 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | reacts violently to form LiOH |
| log P | 9.23 |
| معامل الانكسار (nD) | 1.644 [1] |
| البنية | |
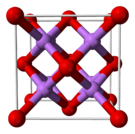
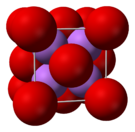
| البنية البلورية | أنتيفلوريت (مكعب)، cF12 |
| الزمرة الفراغية | Fm3m, No. 225 |
| هندسة إحداثية |
رباعي الأسطح (Li+)؛ مكعب (O2−) |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-20.01 kJ/g or -595.8 kJ/mol |
| Standard molar entropy S |
37.89 J/mol K |
| سعة الحرارة النوعية، C | 1.8105 J/g K or 54.1 J/mol K |
| المخاطر | |
| خطر رئيسي | أكال، يتفاعل بعنف مع الماء |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيد الليثيوم سلنيد الليثيوم تلوريد الليثيوم پولونيد الليثيوم |
كاتيونات أخرى
|
أكسيد الصوديوم أكسيد الپوتاسيوم أكسيد الروبيديوم أكسيد السيزيوم |
| پروكسيد الليثيوم فوق أكسيد الليثيوم | |
مركـّبات ذات علاقة
|
هيدروكسيد الليثيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الانتاج
أكسيد الليثيوم يَنتُج من التحلل الحراري لـپروكسيد الليثيوم عند درجة حرارة 300-400 °س.[2]
يتشكل أكسيد الليثيوم بجانب كميات صغيرة من پروكسيد الليثيوم حين يُحرَق فلز الليثيوم في الهواء ويختلط مع الأكسجين:[3]
- 4Li + O 2 → 2Li 2O.
أكسيد الليثيوم Li 2O النقي يمكن انتاجه بالتحلل الحراري لپروكسيد الليثيوم Li 2O 2، عند درجة حرارة 450 °س[3]
- 2Li 2O 2 → 2Li 2O + O 2
البنية
يتخذ أكسيد الليثيوم الصلب بنية أنتيفلوريت ذات أربع مراكز Li+ متناسقة وثمان أكاسيد متناسقة.[4]
الطور الغازي للحالة القاعية لجزيء Li 2O هو خطي مع طول رابط يتناسب مع الرابط الأيوني القوي.[5][6] VSEPR theory would predict a bent shape similar to H 2O.
الاستخدامات
يُستخدم أكسيد الليثيوم كـ flux في ceramic glazes؛ ويخلق ألوان زرقاء مع النحاس ودرجات الوردي مع الكوبالت. يتفاعل أكسيد الليثيوم مع الماء والبخار، مشكلاً هيدروكسيد الليثيوم ويجب عزله عنهم.
Its usage is also being investigated for non-destructive emission spectroscopy evaluation and degradation monitoring within thermal barrier coating systems. It can be added as a co-dopant with yttria in the zirconia ceramic top coat, without a large decrease in expected service life of the coating. At high heat, lithium oxide emits a very detectable spectral pattern, which increases in intensity along with degradation of the coating. Implementation would allow in situ monitoring of such systems, enabling an efficient means to predict lifetime until failure or necessary maintenance.
يمكن الحصول على فلز الليثيوم من أكسيد الليثيوم بالتحليل المائي، مطلِقاً الأكسجين كناتج جانبي.
انظر أيضا
المصادر
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ أ ب Wietelmann, Ulrich and Bauer, Richard J. (2005) "Lithium and Lithium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a15_393.
- ^ أ ب Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 978-0-08-022057-4.
- ^ E. Zintl; A. Harder; B. Dauth (1934). "Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums". Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 40: 588–93.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding, D. Bellert, W. H. Breckenridge, J. Chem. Phys. 114, 2871 (2001); DOI:10.1063/1.1349424
