تفاعلات أكسدة-اختزال
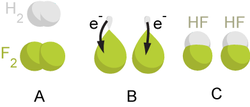
تفاعلات أكسدة-اختزال أو أكسدة-إرجاع هي جميع التفاعلات الكيميائية التي يحدث فيها تغير في عدد أكسدة ذرات المواد المتفاعلة بسبب انتقال الإلكترونات فيما بينها.
يمكن أن تكون عملية الأكسدة-الاختزال عملية بسيطة مثل أكسدة الكربون ليعطي ثنائي أكسيد الكربون، أو إرجاع الكربون بالهيدروجين ليعطي الميثان، كما يمكن أن تكون عملية معقدة مثل أكسدة السكر في جسم الإنسان حيث تتضمن سلسلة معقدة من الانتقالات الإلكترونية.

. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
عوامل الأكسدة والاختزال
- الأكسدة هي عملية فقدان للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات .
- الاختزال هي عملية ربح للإلكترونات من قبل الذرات أو الجزيئات او الأيونات .
وبتعريف أدق يمكن وصف عملية الأكسدة بالنسبة لعنصر ما (أو لجزيء يحوي عنصر تجري عليه هذه العملية) بأنها زيادة في عدد أكسدة هذا العنصر، في حين أن الاختزال (أو الإرجاع) هو النقصان في عدد الأكسدة.
أمثلة
وكمثال على هذه التفاعلات، التفاعل بين الحديد و كبريتات النحاس:
حيث ان التفاعل الأيوني هو:
حيث أن الحديد يتأكسد (عدد أكسدة الحديد ازداد من 0 إلى +2) :
والنحاس يختزل (عدد أكسدة النحاس تناقص من +2 إلى 0) :
تفاعلات الأكسدة-الاختزال في الصناعة
العملية الرئيسية في اختزال الخام لانتاج المعادن مشروحة في مقال صهر.
وتستخدم الأكسدة على نطاق واسع من الصناعات مثل انتاج المنظفات والأمونيا المؤكسدة لانتاج حمض النيتريك، الذي يستعمل في معظم الأسمدة.
تفاعلات الأكسدة-الاختزال هي أساس الخلايا الكهروكيميائية.
انتاج الأقراص المضغوطة يعتمد على تفاعل الأكسدة-الاختزال، الذي يطلي القرص بطبقة رقيقة من رقاقة معدنية.
تفاعلات الأكسدة-الاختزال في علم الأحياء
أسفل: حمض الديهيدروأسكوربيك (الصيغة المأكسدة من ڤيتامين ج)
يتضمن العديد من العمليات الحيوية الهامة تفاعلات أكسدة-اختزال.
التنفس الخلوي، على سبيل المثال، هو أكسدة الگلوكوز (C6H12O6) إلى CO2 واختزال الأكسجين إلى ماء. المعادلة الملخصة لتنفس الخلية هي:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- وتعتمد عملية تنفس الخلية بشدة أيضاً على اختزال NAD+ إلى NADH والتفاعل العكسي (أكسدة NADH إلى NAD+). وما التمثيل الضوئي في الأساس إلا عكس تفاعل الأكسدة-اختزال في تنفس الخلية:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
انظر أيضاً
المصادر
- Schüring, J., Schulz, H. D., Fischer, W. R., Böttcher, J., Duijnisveld, W. H. (editors)(1999). Redox: Fundamentals, Processes and Applications, Springer-Verlag, Heidelberg, 246 pp., ISBN 978-3-540-66528-1 (pdf 3,6 MB)
وصلات خارجية